分子诊断为何突然成为医疗圈的“顶流”?
过去十年,**“精准医疗”**四个字从实验室走向临床,而分子诊断正是它的发动机。传统影像学和生化检测只能告诉我们“有没有病”,分子诊断却能回答“是什么病、为什么得病、怎么治疗”。**全球市场规模从2015年的60亿美元飙升至2023年的180亿美元**,年复合增长率超过15%,这背后有三大推手:

- 技术迭代:二代测序成本从“一辆特斯拉”降到“一部iPhone”;
- 政策加持:中国《“十四五”生物经济发展规划》明确将分子诊断列入战略性新兴产业;
- 需求爆发:肿瘤早筛、遗传病携带者检测、病原微生物快检三大场景同步放量。
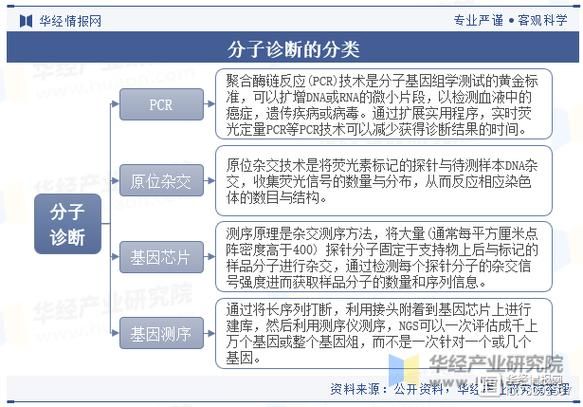
分子诊断技术有哪些?一张表看懂核心差异
| 技术路线 | 检测对象 | 灵敏度 | 代表应用 | 商业化成熟度 |
|---|---|---|---|---|
| PCR(含qPCR、dPCR) | DNA/RNA定量 | 单拷贝级 | 新冠核酸、BRCA突变 | ★★★★★ |
| NGS(二代测序) | 全基因组/外显子/Panel | 0.1%突变频率 | 肿瘤伴随诊断、NIPT | ★★★★☆ |
| FISH(荧光原位杂交) | 染色体结构变异 | 细胞级 | HER2扩增、白血病分型 | ★★★☆☆ |
| 基因芯片 | SNP位点 | 中等 | 药物基因组、遗传筛查 | ★★★☆☆ |
| CRISPR-Dx | 核酸特异性识别 | 单分子级 | 家用HPV试纸、疟疾快检 | ★★☆☆☆ |
自问自答:为什么PCR仍是“现金牛”?**因为快、便宜、合规路径清晰**;而NGS更像“成长股”,需要数据积累与医保谈判。
分子诊断在肿瘤领域的三大颠覆场景
1. 早筛:把癌症拦截在“细胞阶段”
**Grail的Galleri试剂盒**通过一次抽血检测50+癌症信号,特异性达99.5%。国内和瑞基因的“莱思宁”已覆盖6大癌种,灵敏度69.1%。关键突破在于**甲基化标志物+机器学习算法**。
2. 伴随诊断:让靶向药不再“盲打”
EGFR-TKI使用前必须检测EGFR突变,**奥希替尼的适应症直接与EGFR T790M突变挂钩**。FDA已批准40+款伴随诊断产品,国内“艾德生物PCR-11基因”拿下首个肺癌多基因联检证。
3. MRD监测:提前半年发现复发
通过术后ctDNA追踪微小残留病灶,**Signatera技术能在影像学复发前6.5个月预警**。国内臻和科技已将MRD检测价格打到万元级,进入医保谈判目录。
分子诊断下沉基层的三道坎
- 样本运输:县域医院抽血后需72小时内抵达中心实验室,冷链成本占检测费30%;
- 报告解读:90%基层医生看不懂VUS突变,需要AI辅助决策系统;
- 支付模式:LDT(实验室自建项目)与IVD(体外诊断试剂)双轨制下,医保报销比例差异达5倍。
破局案例:**金域医学的“千县联盟”**通过区域病理中心+无人机冷链,将TAT(报告周期)从7天压缩到48小时。
资本寒冬下,分子诊断的下一个风口在哪?
2023年融资数据显示,**“多组学+自动化”**组合吸金能力最强:
- **单细胞测序**:新格元推出“一站式单细胞制备仪”,把实验时间从8小时缩到30分钟;
- **微流控芯片**:华大智造DNBSEQ-E25实现“样本进-结果出”,单机日通量2500例;
- **家用自检**:诺辉健康的“幽幽管”用粪便检测幽门螺杆菌,2023年销量破500万支。
自问自答:投资人最关心什么指标?**不是技术先进性,而是“单例成本能否降到医保可承受的临界点”**。以肠癌早筛为例,当检测价低于300元时,渗透率可从5%跃升至30%。
监管沙盒里的“灰色地带”如何转正?
中国目前对LDT实行“备案制”,但2024年《医疗器械监督管理条例》修订草案拟将**部分高风险项目纳入III类证管理**。这意味着:
- 已有LDT产品的企业需**在18个月内完成临床试验**;
- 第三方实验室必须与三甲医院共建“联合实验室”才能延续服务;
- 数据安全成为新门槛——**人类遗传信息需通过科技部审批**方可出境。
头部玩家对策:**燃石医学**选择“两条腿走路”,一边冲刺IVD注册证,一边用LDT模式服务高端私立医院。
写在最后:分子诊断的终局是“消失”
当检测成本趋近于零、数据解读由AI完成、治疗决策由算法推荐时,**分子诊断将像血常规一样成为基础设施**。真正的竞争壁垒不再是技术,而是**谁能建立覆盖“检测-解读-干预-随访”的闭环生态**。

评论列表