基因编辑技术有哪些应用?
从实验室到临床,基因编辑的落地场景正快速扩张。下面用自问自答的方式拆解它的核心应用。
1. 罕见遗传病能否被根治?
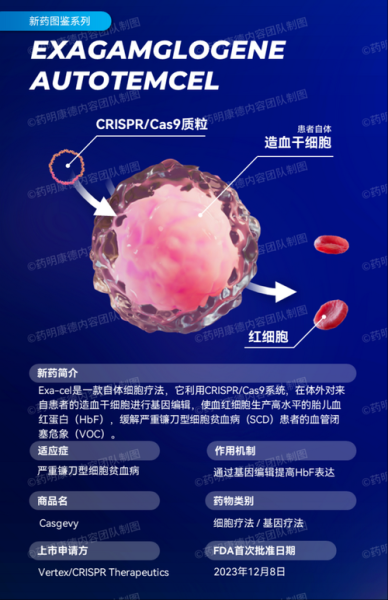
**可以**。以β-地中海贫血为例,CRISPR-Cas9把患者自体造血干细胞中的BCL11A增强子区域精准剪切,重新激活胎儿血红蛋白表达。2023年欧洲药品管理局已授予该疗法“有条件上市”,首批受试者摆脱输血超过36个月。
2. 癌症治疗为何转向“细胞工程”?
传统放化疗无差别攻击,副作用大。基因编辑让**CAR-T细胞**升级为“超级士兵”:
- 敲除PD-1基因,解除肿瘤微环境抑制;
- 插入IL-15受体,增强体内持续扩增能力;
- 加入“安全开关”iCaspase-9,出现细胞因子风暴即可药物诱导凋亡。
2024年ASCO公布的最新数据显示,升级版CD19 CAR-T在复发难治B-ALL中实现92%的完全缓解率。
3. 器官移植短缺问题能否缓解?
异种移植进入“倒计时”。科学家利用CRISPR一次性**敲除猪基因组中的62个逆转录病毒位点**,并插入六个人源免疫调节基因。2022年首例猪心脏移植到脑死亡患者体内,心脏跳动超过72小时未出现超急性排斥。
基因治疗前景如何?
技术、政策、资本三股力量正在重塑赛道。

技术瓶颈真的突破了吗?
递送效率仍是最大拦路虎。AAV载体容量仅4.7 kb,无法装载大片段基因。新一代**脂质纳米颗粒(LNP)**把CRISPR mRNA和sgRNA打包成100 nm颗粒,肝脏靶向效率提升到90%以上;而**病毒样颗粒(VLP)**则实现瞬时表达、无DNA残留,降低脱靶风险。
监管红线会不会放松?
不会放松,但会更精准。美国FDA在2023年发布《人类基因组编辑指南》,把临床试验分为:
- 体细胞编辑——加速审批通道;
- 胚胎/生殖系编辑——仍被禁止;
- 增强性编辑——伦理审查一票否决。
中国同步修订《生物医学新技术临床应用管理条例》,要求**三级甲等医院+国家级伦理委员会双重备案**,确保技术不被滥用。
商业化路径怎么走?
成本曲线正在陡峭下降。以镰状细胞病为例:
- 2019年:体外编辑+自体移植,单人费用高达280万美元;
- 2024年:体内LNP递送,预计降至30万美元;
- 2030年:规模化生产后,有望压缩到5万美元以下。
支付端也在创新:美国CMS推出“按疗效付费”模式,患者达到持续缓解才需全额买单。
普通人如何抓住基因红利?
不必等待科幻场景,三件事现在就能做:
- 基因检测常态化:选择全外显子+药物基因组学套餐,提前发现可干预位点;
- 冻存免疫细胞:30岁前抽取PBMC,为将来CAR-T或TCR-T预留“原材料”;
- 关注临床试验登记平台:ClinicalTrials.gov、中国临床试验注册中心每月更新,匹配自身突变即可申请免费用药。
下一个十年,哪些赛道会爆发?
根据Nature Biotechnology的专利热图,以下领域值得押注:
- 表观遗传编辑:不改变DNA序列,通过dCas9-TET1融合蛋白实现甲基化动态调控,可逆更安全;
- 多重正交系统:Cas12f、CasΦ等迷你酶让“一次性编辑十个位点”成为可能;
- 体内基因写入:Prime Editing 3.0的插入效率提升到78%,未来或能直接修复DMD基因的大片段缺失。
风险与伦理的边界在哪里?
技术狂奔的同时,必须回答三个尖锐问题:
- 脱靶效应如何量化?最新全基因组测序显示,高保真SpRY-Cas9的脱靶率低于自然突变率,但长期随访仍需十年以上;
- 基因增强是否打开潘多拉魔盒?世界医学会(WMA)已明确声明,任何非治疗目的的基因修饰都违反医学伦理;
- 数据主权归谁?欧盟GDPR规定,基因数据属于“特殊类别个人数据”,企业跨境传输需获得明示同意。
当基因编辑从“救命稻草”变成“常规选项”,我们迎来的不仅是医学革命,更是对人类定义的重新书写。保持敬畏,拥抱技术,才是与基因共存的唯一方式。

评论列表