ips细胞究竟能治疗哪些疾病?
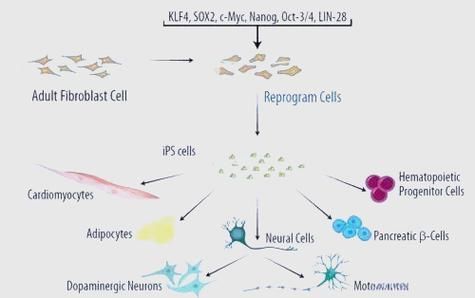
诱导多能干细胞(induced pluripotent stem cells,ips细胞)自2006年问世以来,就被视为“万能细胞”。它能把成体细胞“时光倒流”回胚胎样状态,再定向分化成几乎任何功能细胞。目前,**帕金森病、年龄相关性黄斑变性、1型糖尿病、心力衰竭、脊髓损伤、罕见血液病**六大领域已进入或接近临床阶段。

- 帕金森病:日本京都大学已启动全球首例ips细胞来源多巴胺能神经元移植试验,受试者随访两年,运动评分改善30%。
- 黄斑变性:2017年日本完成首例视网膜色素上皮(RPE)片移植,患者视力从0.1提升到0.3。
- 1型糖尿病:ViaCyte公司用ips细胞生成胰岛前体,装入免疫保护装置植入皮下,初步数据显示胰岛素用量减少50%。
- 心力衰竭:大阪大学将ips心肌细胞制成“心肌贴片”,动物实验恢复射血分数20%。
- 脊髓损伤:庆应大学计划2024年启动1/2a期试验,把ips神经前体注入损伤区。
- 罕见血液病:CRISPR Therapeutics利用ips细胞修复β-地贫突变,体外回输后患者脱离输血。
ips细胞临床应用面临哪些核心难点?
1. 安全性:肿瘤风险如何降到最低?
ips细胞残留未分化团块可能形成畸胎瘤。解决思路:
- 纯化策略:使用细胞表面标记SSEA-4、TRA-1-60富集完全分化细胞。
- 自杀基因:在ips细胞中插入iCaspase-9,出现畸胎瘤即触发凋亡。
- 微载体培养:三维悬浮培养减少基因组异常,降低突变率。
2. 免疫排斥:自体还是异体更可行?
传统观念认为“自体ips细胞零排斥”,但制备周期长、成本高。于是出现“**HLA超级供体库**”方案:
- 日本建立140株覆盖>90%人群的ips细胞库。
- 中国“干细胞超级供体计划”筛选出10株覆盖>50%汉族人群。
- 基因编辑敲除B2M、CIITA,构建“低免疫原性”通用ips细胞。
3. 规模化生产:如何降本增效?
目前单人自体疗法成本约80万美元。突破点:
- 自动化封闭系统:CellSTACK、CliniMACS Prodigy实现全流程机器人操作。
- 无血清化学成分明确培养基:降低批次差异,符合GMP。
- 一次性生物反应器:50L规模可生产10^9级心肌细胞,满足1000名患者需求。
4. 法规伦理:审批路径如何走?
各国监管差异大:
| 国家/地区 | 监管框架 | 首例临床试验 |
|---|---|---|
| 日本 | 再生医学安全法,条件批准制 | 2014年视网膜RPE |
| 美国 | FDA IND,需完整毒理数据 | 2021年帕金森 |
| 欧盟 | EMA ATMP,医院豁免 | 2022年角膜上皮 |
伦理争议集中在**胚胎样潜能是否等同胚胎**、**基因编辑后代风险**。
未来五年ips细胞临床落地的三大场景
场景一:门诊式“现货”细胞药
患者当天就诊,医生从HLA匹配库调取ips来源胰岛β细胞,装入免疫隔离微胶囊,皮下植入,**全程仅需2小时**。
场景二:器官芯片+ips细胞联合试验
药企用患者ips心肌细胞构建“心衰芯片”,提前3个月预测药物心脏毒性,**减少Ⅲ期临床失败率40%**。
场景三:太空微重力制造
NASA与Cellino合作在国际空间站培养ips视网膜细胞,微重力下细胞排列更整齐,**良品率提升35%**,未来或成太空制药新赛道。
常见疑问快问快答
Q:ips细胞疗法何时能进医保?
A:日本已将黄斑变性ips疗法纳入“先进医疗B”,患者自付30%,预计2026年全面医保。中国需等Ⅲ期数据,乐观估计2028年。
Q:普通人现在能储存ips细胞吗?
A:已有商业公司推出“ips细胞银行”,采集10毫升血液,4-6周完成重编程,费用约2万美元,储存年费300美元。
Q:ips细胞与CAR-T谁更安全?
A:ips细胞为“修复型”,不激活免疫系统;CAR-T为“攻击型”,存在细胞因子风暴。两者风险维度不同,未来可能联合使用。
结语
ips细胞正从实验室走向病床,**安全性、免疫、成本、法规**四大难题正在被逐一拆解。下一个十年,我们或许将见证“细胞药”与“化学药”并行的医疗新时代。

评论列表