医疗器械备案流程是什么?一步一步拆解
很多初创企业第一次接触医疗器械,都会问:医疗器械备案流程是什么?其实,备案与注册是两条不同的路径,备案更简单,适用于风险较低的一类器械;注册则针对二类、三类。下面以一类医疗器械备案为例,拆解完整步骤。

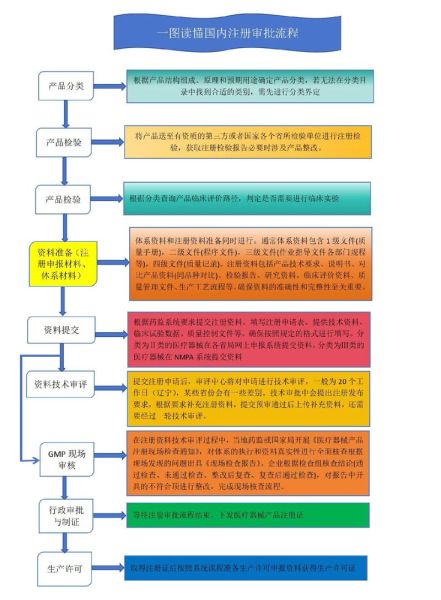
第一步:确认产品管理类别
先登录国家药监局医疗器械分类目录,输入产品名称或预期用途,核对是否属于一类。若目录中找不到,可申请分类界定,通常20个工作日内给出书面答复。
第二步:准备备案资料
- 产品技术要求:包含性能指标、检验方法,需由企业盖章。
- 检验报告:可在具备CMA资质的第三方实验室完成,周期7-10天。
- 临床评价资料:一类器械通常豁免临床,只需提交同品种比对说明。
- 生产制造信息:工艺流程图、生产场地证明、设备清单。
- 标签样稿:必须标注备案号格式:×械备××××××××号。
第三步:在线提交与窗口递交
登录国家药监局医疗器械注册管理信息系统,选择“备案”入口,逐项上传PDF资料。提交后,系统将生成《第一类医疗器械备案表》,打印并加盖骑缝章,再到企业所在地市级药监窗口递交纸质件。
第四步:备案凭证领取
资料齐全且符合形式审查要求,药监部门当场发放《第一类医疗器械备案凭证》,并同步在国家药监局官网公示。整个周期:资料准备2周+递交当天出证。
二类医疗器械注册需要多久?关键节点与时间清单
若产品被划分为二类,流程立刻升级。企业最关心的问题就是:二类医疗器械注册需要多久?以常见的心电监护仪为例,完整周期约10-14个月,具体取决于检验、临床、审评三大环节。
节点一:注册检验
送检样品需覆盖所有型号,检测机构排队时间1-3个月,检测周期2-4个月。若想加速,可优先选择国家十大医疗器械检验中心,并提前半年预约。
节点二:临床评价路径选择
二类器械并非全部要做临床试验,可先做同品种比对。若找不到合适对比产品,再启动临床试验。后者需经过伦理审批、遗传办审批(如涉及外资),整体耗时6-8个月。
节点三:注册资料编制
核心文件《医疗器械注册申报资料》包含:
- 综述资料:结构组成、工作原理、适用范围。
- 研究资料:性能研究、生物相容性、灭菌确认。
- 临床资料:同品种比对报告或临床试验报告。
- 质量管理体系文件:ISO13485证书、生产现场核查报告。
资料厚度通常300-500页,建议由注册专员+法规顾问+研发工程师三方联审,减少发补概率。
节点四:受理与审评
资料递交至省级药监,形式审查5个工作日;技术审评60个工作日;若发补,企业需在1年内一次性补齐。补资料后再审60个工作日。因此发补一次≈多等4个月。
节点五:体系核查与行政审批
技术审评通过后,省局会安排生产现场核查,重点查看设计开发、采购、生产管理、质量控制四大模块。核查通过,进入行政审批20个工作日,最终领取《医疗器械注册证》。

如何缩短注册周期?三个实战技巧
企业若想抢市场,时间成本比金钱更贵。以下技巧来自50+成功注册项目的复盘:
技巧一:提前一年锁定检测机构
每年3月、9月是送检高峰,排队时间翻倍。建议在产品定型前就联系检测机构,完成预评价,减少正式检测时的整改。
技巧二:临床方案前置
若确定要做临床试验,可在注册检验阶段同步起草临床试验方案,并提前与CRO公司、医院伦理委员会沟通,节省伦理审批时间。
技巧三:发补预判机制
建立内部发补清单,对照《医疗器械注册审评共性问与答》逐条自查,重点检查软件研究资料、有效期验证、运输稳定性三类高频发补点。
常见疑问快问快答
问:一类器械备案后还能升级成二类注册吗?
答:可以。若后续增加新功能或改变预期用途,导致风险等级提升,需按二类重新注册,原备案号自动失效。
问:注册证有效期届满前多久申请延续?
答:在有效期届满6个月前向原审批部门提交延续申请,逾期视为重新注册。
问:进口二类器械在国内注册是否更快?
答:不会。进口产品需额外提交境外上市证明、公证认证文件,且现场核查改为境外核查,整体周期可能更长。
写在最后
无论是备案还是注册,核心逻辑只有一条:用法规语言证明产品安全有效。提前规划、节点并行、资料严谨,就能把“不可控”变成“可预期”。
```

评论列表