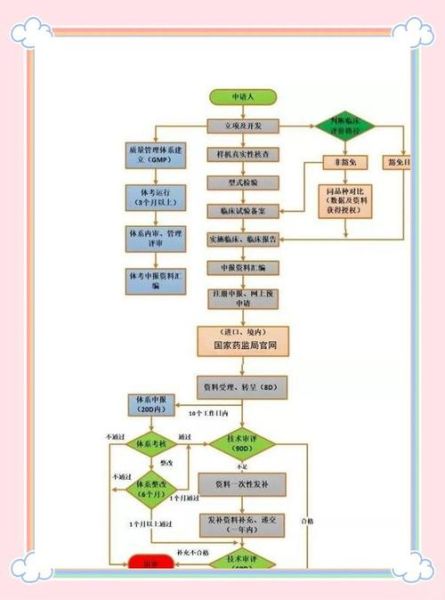
为什么FDA认证对出口美国如此关键?
美国市场占全球医疗器械销售额的40%以上,未获得FDA 510(k)或PMA批准的产品无法合法销售。FDA不仅是门槛,更是品牌信誉背书,直接影响医院采购决策与保险报销。
(图片来源网络,侵删)
510(k)与PMA:选错路径多花6个月
510(k)适用场景
- 实质等效性:对比已上市器械,无需临床试验
- 平均周期:90-120个工作日
- 费用:$12,745(标准收费)
PMA强制情形
- 高风险Class III:如心脏起搏器
- 需多中心临床试验数据
- 周期:180-320天,费用超$30万
如何90天内完成510(k)文件?
第一步:Predicate Device精准匹配
在FDA数据库搜索3年内同类产品,记录K号与对比参数。差异超过10%需补充测试报告。
第二步:生物相容性测试提前做
ISO 10993系列测试需6-8周,建议与第三方实验室签订加急协议(费用增加30%但节省2周)。
第三步:QSR体系预审核
FDA现场检查重点查:设计控制、CAPA、供应商管理。提前聘请有QSIT经验的审核员模拟检查,可降低50%发补概率。
临床数据豁免的隐藏条件
即使510(k)路径,以下情况仍需临床:
- 新材料接触血液超过30天
- 软件算法影响诊断阈值
- 能量输出模式超出已批准范围
解决方案:通过FDA Q-Sub会议提前确认,费用仅$3,000,比补交试验节省$20万。

(图片来源网络,侵删)
De Novo申请:创新器械的绿色通道
无predicate device时,De Novo可将Class III降为Class II。关键策略:
- 提交风险分析矩阵证明可通过特殊控制管理
- 引用欧盟MDR临床评价减少重复试验
- 平均周期:120天,成功率78%
质量体系常见雷区
| 缺陷项 | 占比 | 快速整改方案 |
|---|---|---|
| 设计变更未重新验证 | 34% | 建立版本控制矩阵关联风险分析 |
| 供应商审核缺失 | 28% | 采用ISO 13485认证供应商可豁免现场审核 |
| CAPA未闭环 | 22% | 使用5Why工具追溯根本原因 |
支付方编码:被忽视的上市加速器
即使获批,无CPT/HCPCS代码影响报销。策略:
- 同步申请CMS平行审查(需额外6周)
- 联合美国医院协会提交代码申请
- 通过ICD-10-CM关联适应症扩大覆盖
2024年FDA新规3大变化
- 网络安全:所有联网器械需提交威胁建模文档
- 人因工程:用户界面测试需包含75岁以上受试者
- eSTAR模板强制使用,拒收率从25%降至8%
实战案例:血糖仪如何45天获批
某深圳企业通过:
- 选择2019年获批的K号作为predicate,差异仅软件算法
- 提交510(k) Summary时突出蓝牙加密协议符合UL 2900
- 利用第三方510(k)审查机构(如TUV SUD)加急通道
最终43天获批,节省3个月上市时间。

(图片来源网络,侵删)

评论列表