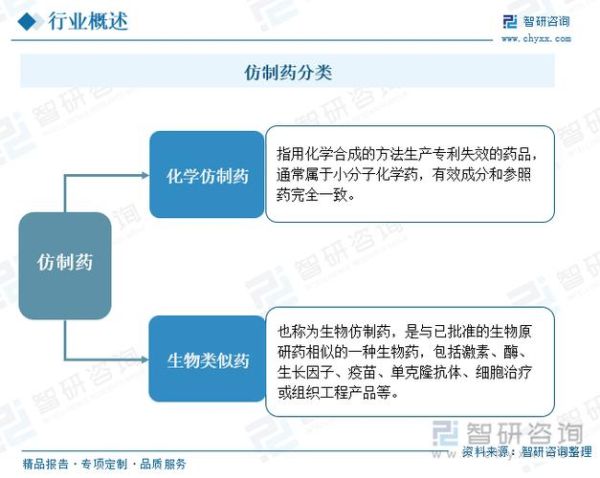
什么是仿制药一致性评价?
仿制药一致性评价,指的是国家药监局要求已上市的仿制药,在质量、疗效、安全性三个维度上,与原研药进行系统对比,证明其“等效”。通过评价后,药品才能在招标、医保支付、医院采购中享受与原研药同等待遇。
为什么一致性评价是行业生死线?
自2016年启动以来,一致性评价已成为仿制药企业准入门槛。未通过的品种:
- 失去公立医院市场,销量断崖式下跌;
- 无法参与国家集采,价格优势归零;
- 资本市场上估值被大幅下调。
因此,“过评”=活下去,“不过评”=出局。
---一致性评价怎么做?全流程拆解
1. 立项:选品与立项报告
企业先筛选市场容量大、原研专利到期、技术壁垒适中的品种。立项报告需包含:
- 参比制剂信息(原研药批次、规格、产地);
- 原料药晶型、杂质谱对比;
- BE试验设计思路。
2. 药学等效:质量对比实验
在体外溶出曲线、杂质谱、稳定性三大核心指标上,仿制药必须与参比制剂“四条曲线完全重合”。常见难点:
- 原料药粒径分布差异导致溶出偏差;
- 辅料来源更换引起杂质超标。
3. 生物等效(BE):人体试验
招募24~36名健康受试者,进行空腹+餐后双交叉试验。关键参数:

- Cmax(峰浓度)比值80%~125%;
- AUC(曲线下面积)比值80%~125%。
一次BE试验成本约200万~400万元,失败即重来。
4. 申报与核查
资料递交后,药监局会飞行检查生产现场,重点核对:
- 工艺与注册批一致性;
- 数据完整性(防止“修改时间戳”)。
仿制药市场前景如何?三大维度透视
1. 政策端:集采常态化,利润压缩但规模放大
第七批集采平均降价48%,但中标企业销量增长200%~500%。未来趋势:
- 品种范围从口服固体制剂扩展到注射剂、生物类似药;
- 省级联盟集采补充,形成“国家+省”双层采购网。
2. 需求端:老龄化+医保控费双轮驱动
中国60岁以上人口占比19%,慢性病用药需求年增10%。医保基金收支缺口扩大,仿制药替代率需从60%提升至80%。
3. 竞争端:集中度提升,龙头赢家通吃
截至2023年底,TOP20企业占据过评批文数量的58%。中小型企业面临:
- 研发资金不足,BE试验外包成本上涨30%;
- 原料药被上游垄断,利润进一步挤压。
企业如何突围?实战策略
策略一:差异化立项
避开“红海”品种,选择:
- 缓控释制剂(技术壁垒高,竞争者少);
- 复方制剂(专利悬崖晚,生命周期长)。
策略二:原料药-制剂一体化
自建原料药生产线,可降低30%成本,同时保障供应稳定性。典型案例:华海药业通过垂直整合,氯沙坦钾片毛利率维持在65%以上。
策略三:国际化“曲线救国”
通过ANDA(美国仿制药申请)或EMA(欧洲药品管理局)认证,反哺国内市场:
- 优先审评通道,缩短国内上市时间6~12个月;
- 提升品牌溢价,医院议价能力提升。
未来五年,哪些赛道值得押注?
1. 复杂制剂
包括脂质体、微球、吸入剂,国内仅10%品种实现国产化,毛利率可达80%。
2. 专利挑战
针对2025~2030年到期的重磅炸弹药物(如阿哌沙班、恩格列净),提前布局PIV专利挑战,成功后享180天市场独占期。
3. 生物类似药
中国生物药市场规模2025年将破2000亿元,类似药渗透率不足15%。胰岛素、阿达木单抗类似药已进入收获期。
---投资者如何筛选标的?
看三个核心指标:
- 过评品种数量:≥10个批文的企业具备规模效应;
- 研发费用率:维持在8%~12%,过低则创新能力不足,过高则盈利承压;
- 国际化收入占比:≥20%可对冲国内集采风险。
例如,**某头部企业2023年财报显示:过评批文35个、研发费用率10.5%、美国ANDA收入占比28%,**估值溢价显著高于行业平均。

评论列表