从实验室里的一粒化合物,到患者手中的一盒药,平均需要10—15年,耗资20—30亿美元。为什么时间如此漫长?流程到底卡在哪一步?下面用自问自答的方式拆解全过程,并穿插最新政策与技术对周期的影响。
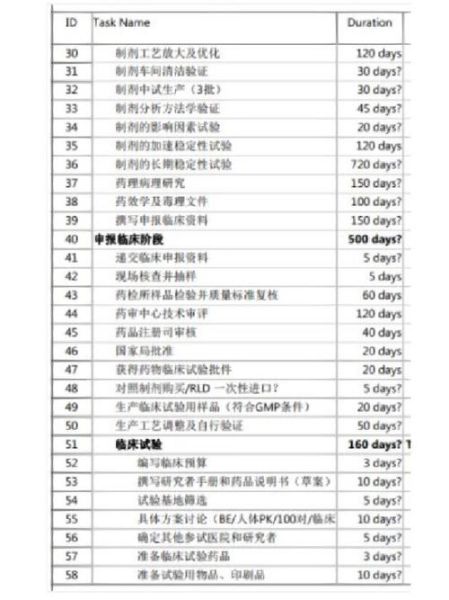
药物研发周期多久?各阶段时间一览
答案:平均10—15年,其中临床前2—4年、临床Ⅰ—Ⅲ期6—8年、审批0.5—2年、上市后监测持续进行。
- 发现与优化:2—4年。从靶点验证到候选化合物确定,命中率不足0.01%。
- 临床前研究:1—2年。毒理、药代、制剂工艺,一次性通过率约60%。
- 临床试验:
- Ⅰ期:1年左右,20—100例健康志愿者,安全性为主。
- Ⅱ期:2—3年,100—300例患者,探索剂量与初步疗效。
- Ⅲ期:3—4年,1000—3000例患者,大规模验证疗效与风险。
- 注册审评:0.5—2年。中美欧均有加速通道,最快6个月。
- Ⅳ期上市后研究:持续5年以上,监测罕见不良反应。
新药上市流程详解:每一步在做什么?
1. 靶点发现:如何确定“打哪里”?
研究者先通过基因组学、蛋白组学筛选疾病相关通路,再用CRISPR敲除或RNA干扰验证靶点必需性。一个肿瘤靶点从提出到被行业公认,平均需要3—5年文献与数据积累。
2. 先导化合物:如何从百万分子中筛出“种子”?
采用高通量筛选(HTS)每天可测10万分子,但真正进入动物实验的不足0.1%。近年AI虚拟筛选把命中率提高3—5倍,例如英矽智能用AI设计的抗纤维化药物已进入Ⅱ期。
3. 临床前研究:动物实验到底测什么?
- 药效学:小鼠、大鼠、犬、猴四级递进,证明“有效”。
- 毒理学:急性、亚慢性、生殖毒性,GLP实验室完成。
- 药代动力学:ADME(吸收、分布、代谢、排泄)决定人用剂量。
失败常卡在心脏毒性(hERG)或肝酶诱导,导致约40%候选药在此阶段终止。
4. 临床试验:Ⅰ、Ⅱ、Ⅲ期分别解决什么问题?
Ⅰ期:最大耐受剂量(MTD)是多少?
Ⅱ期:最佳剂量与适应症如何匹配?
Ⅲ期:与标准治疗相比,能否显著延长生存期或减少副作用?
关键痛点是患者招募,肿瘤试验平均招募时间占Ⅲ期总时长30%以上。数字化招募平台(如Deep6 AI)可将周期缩短3—6个月。
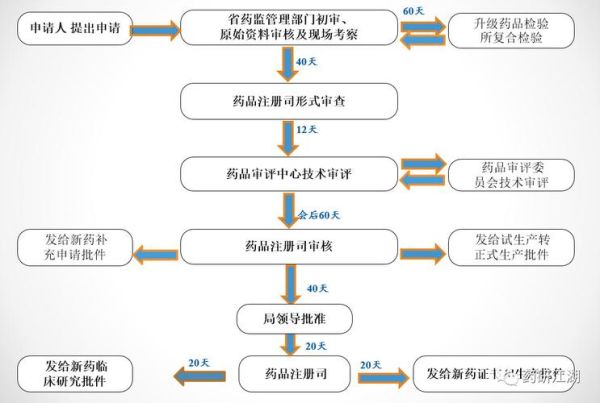
5. 注册审评:中美欧三大市场的差异
| 地区 | 常规审评时长 | 加速通道 | 2023年案例 |
|---|---|---|---|
| 中国NMPA | 200工作日 | 突破性治疗(BTD)可缩短至60工作日 | 恒瑞医药卡瑞利珠单抗 |
| 美国FDA | 12个月 | 突破性疗法(BTD)、优先审评(Priority Review) | 礼来Donanemab阿尔茨海默病药 |
| 欧洲EMA | 210天 | PRIME计划 | BioNTech个性化肿瘤疫苗 |
哪些技术正在压缩研发周期?
1. AI+自动化实验
晶泰科技用机器人实验工站将晶型筛选从6个月压缩到6周。
2. 真实世界证据(RWE)
FDA已接受RWE作为Ⅳ期补充数据,安进使用电子健康记录(EHR)将PSCK9抑制剂的额外适应症申请时间缩短18个月。
3. 适应性临床试验设计
无缝Ⅰ/Ⅱ期设计让早期疗效信号直接决定剂量扩展,整体节省1—2年。
政策红利:中国如何再提速?
- 60天临床试验默示许可:2018年改革后,IND申报从“审批制”变“默许制”。
- 港澳药械通:2023年起,粤港澳大湾区可同步使用港澳已上市新药,患者提前1—2年获益。
- 真实世界数据试点:海南博鳌乐城已有30余个特许药械通过RWD获批国内注册。
未来展望:10年周期能否再减半?
综合AI、适应性试验、监管科学三大杠杆,业界普遍预测2035年可将平均周期压到7—8年。但伦理与数据安全仍是底线,任何提速都不能以牺牲患者安全为代价。

评论列表