医疗器械注册到底要多久?平均周期:第二类器械约10-14个月,第三类器械约12-18个月,创新通道可缩短30-50%。
(图片来源网络,侵删)
一、注册前必须搞清的三个核心问题
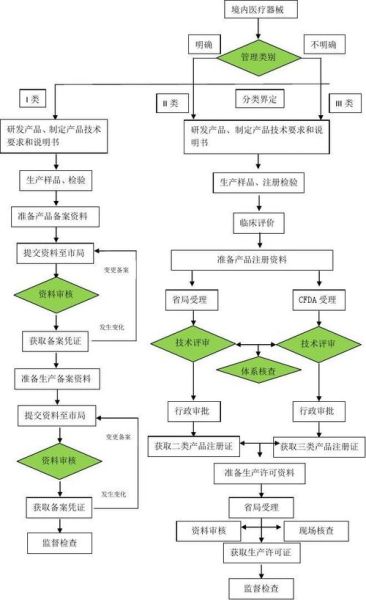
1. 我的产品到底算哪一类?
国家药监局把器械分成三类:I类风险低、II类中度、III类高风险。判断方法:
- 看《分类目录》关键词匹配
- 比对已上市同类产品文号
- 实在拿不准就做分类界定申请,官方20个工作日给书面答复
2. 临床评价一定要做试验吗?
不一定!有三条路:
- 豁免临床:目录内产品直接走同品种比对
- 临床评价:用已发表文献+上市后数据拼出证据链
- 临床试验:高风险或全新机制产品绕不过去
3. 注册资料到底有多厚?
以III类无源植入物为例,全套资料≈800-1200页,包含:
- 综述资料(产品概述、适用范围)
- 研究资料(性能研究、生物相容性、灭菌验证)
- 生产制造信息(工艺流程图、关键控制点)
- 临床评价资料
- 产品风险分析
- 说明书和标签样稿
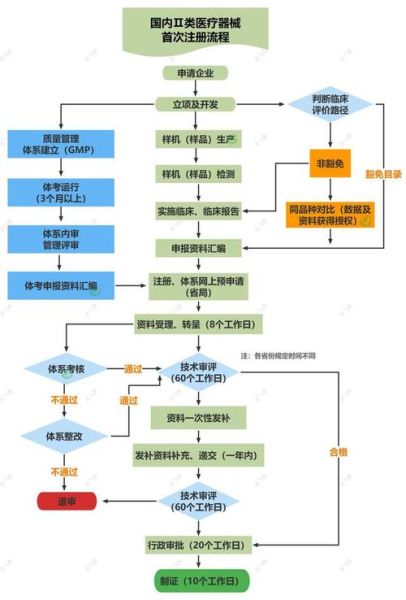
二、注册流程拆解:从立项到拿证
阶段1:立项与检测(2-4个月)
关键动作:
- 选定国家药监局认可的10大检测所之一送检
- 提前3个月排队,热门项目检测周期可能翻倍
- 拿到型式检验报告才能启动临床
阶段2:临床评价或试验(3-12个月)
不同路径时间差异巨大:
(图片来源网络,侵删)
| 路径 | 平均耗时 | 费用区间 |
|---|---|---|
| 豁免临床 | 1个月 | 5-10万 |
| 同品种比对 | 3-6个月 | 20-50万 |
| 临床试验 | 8-12个月 | 200-800万 |
阶段3:注册申报与审评(6-9个月)
电子申报系统(eRPS)提交后:
- 形式审查(5个工作日):资料缺件会发补正通知书
- 技术审评(60/90个工作日):II类60天,III类90天
- 发补资料(1-3轮):每轮补正消耗1-2个月
- 行政审批(20个工作日)
三、加速通道:三类特殊路径对比
创新医疗器械特别审查
条件:国内首创+显著临床优势
- 审评时限缩减30%
- 可前置沟通,提前解决技术争议
- 2023年通过率约25%,心血管介入类产品占比最高
应急审批
适用场景:突发公共卫生事件
典型案例:新冠抗原检测试剂盒26天拿证
优先审批
针对诊断或治疗罕见病、恶性肿瘤的器械
(图片来源网络,侵删)
审评时限压缩20%,需提交临床急需证明
四、企业最容易踩的五个坑
1. 检测所选择错误
某骨科企业因生物相容性检测所无资质,被迫重做实验,损失3个月+50万
2. 临床方案设计缺陷
对照组选择不当导致统计学差异不显著,被迫扩大样本量
3. 发补资料准备不足
审评老师要求补充有效期验证数据,企业仓库却无留样,需重新生产
4. 生产地址变更未报备
注册过程中搬迁厂房,未提前申请许可事项变更,导致发补
5. 说明书适应症过宽
某消融导管因适应症描述超出临床验证范围,被勒令修改
五、2024年新政策影响
注册电子申报升级
4月起全部III类产品必须采用XML格式提交,旧版PDF将被拒收
临床真实世界数据应用
海南博鳌试点允许用境外临床数据+真实世界证据替代部分临床试验
自检报告试点扩大
具备CNAS认证实验室的企业,可对部分性能指标开展自检并直接用于注册
六、实战建议:如何制定项目时间表
甘特图模板(III类无源植入物)
月份 1-3 4-6 7-9 10-12 13-15 16-18 检测 ████ 临床 ████████ 申报 ████████ 发补 ██ 审批 ████
关键里程碑
- T0:项目启动会(确定分类、检测所)
- T+3个月:型检报告到手
- T+9个月:首例临床入组
- T+15个月:提交注册申请
- T+18个月:获批生产许可证
七、费用预算参考(III类产品)
| 项目 | 费用范围 | 备注 |
|---|---|---|
| 检测费 | 15-30万 | 含电气安全、EMC、生物相容性 |
| 临床试验 | 200-800万 | 按病例数浮动 |
| 注册代理 | 30-80万 | 含资料编写、发补应对 |
| 体系核查 | 5-10万 | 含整改咨询 |
| 总预算 | 250-920万 | 不含厂房改造 |

评论列表